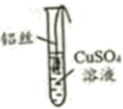
1.
科学的发展必须经历漫长的探索过程,人类对金属活动性规律的认识过程如图。

(1)
用金、银、镁三种金属重温格劳贝尔实验。分析“消失”的金属是。
(2)
重现贝开托夫实验:将已打磨且形状、大小相同的锌、铜、锰(Mn)片分别放入8%的稀盐酸中,观察到锰片和锌片周围立即产生气泡,且锰的速率较快;铜片上无明显现象。则锌、铜、锰的金属活动性顺序由强到弱为。
(3)
将一定量的铝片和稀硫酸放在密闭容器中,用传感器探究反应容器内的压强随时间变化如图。0-50s时,容器内压强几乎不变的原因是,50s以后容器内压强逐渐增大的原因是(用化学方程式表示)。

【考点】
金属的化学性质;
金属活动性顺序及其应用;
能力提升
真题演练