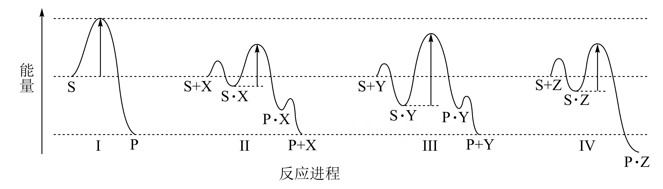
1.
在处理汽车尾气的三元催化剂中,Rh的主要作用是消除 , Pd的主要作用是消除CO,部分催化机理及能量变化如图所示。下列说法不正确的是( )
, Pd的主要作用是消除CO,部分催化机理及能量变化如图所示。下列说法不正确的是( )
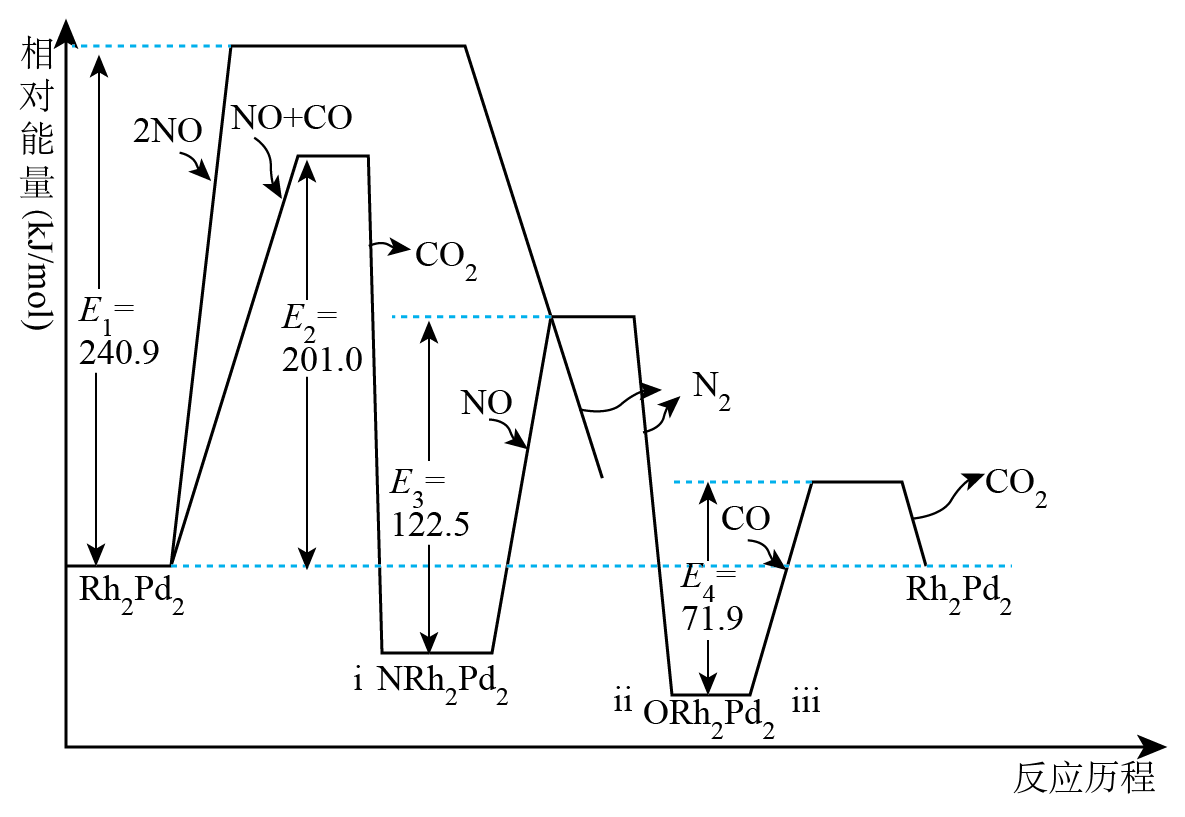
A.
在NO和CO的整个反应过程中步骤Ⅲ是决速步骤
B.
反应进行的三步分别是放热反应、放热反应和吸热反应
C.
第一步反应: D.
CO能促进NO转化成
D.
CO能促进NO转化成
【考点】
活化能及其对化学反应速率的影响;
催化剂;
基础巩固
能力提升
变式训练
拓展培优
真题演练