1.
某兴趣小组同学用图所示实验验证质量守恒定律。
已知:

(1)
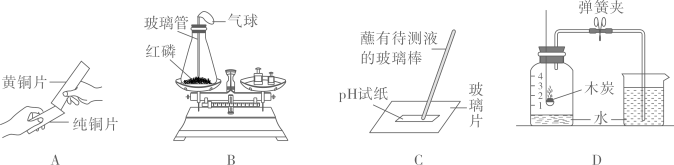
若用图 装置做实验,将橡皮塞上的玻璃管放到酒精灯火焰上灼烧至红热后,将玻璃管下端接触到白磷,并迅速塞紧橡皮塞。之后观察到锥形瓶内的现象是 。反应的化学方程式为 ,玻璃管除了导气的作用外还有 的作用,小气球的作用除了密闭装置还有 的作用。
(2)
某同学按图
装置做实验,将橡皮塞上的玻璃管放到酒精灯火焰上灼烧至红热后,将玻璃管下端接触到白磷,并迅速塞紧橡皮塞。之后观察到锥形瓶内的现象是 。反应的化学方程式为 ,玻璃管除了导气的作用外还有 的作用,小气球的作用除了密闭装置还有 的作用。
(2)
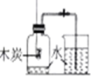
某同学按图 装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应
装置对质量守恒定律进行实验探究,观察到反应后天平不平衡,该反应  填“遵守”或“不遵守”
填“遵守”或“不遵守” 质量守恒定律,反应后天平不平衡的原因是 。
(3)
将图
质量守恒定律,反应后天平不平衡的原因是 。
(3)
将图 装置改成图
装置改成图 装置
装置 气密性良好
气密性良好 , 将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是
, 将充分反应后的锥形瓶放回左盘,发现指针没有停在中间,而是  填“偏右”或“偏左”
填“偏右”或“偏左” , 你认为可能的原因是 。
(4)
小华将图
, 你认为可能的原因是 。
(4)
小华将图 改成图
改成图 装置,已知氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,该装置
装置,已知氢氧化钠溶液能与二氧化碳反应生成碳酸钠和水,该装置  填“能”或“不能”
填“能”或“不能” 验证质量守恒定律。
(5)
某超市卖的纯碱
验证质量守恒定律。
(5)
某超市卖的纯碱 产品往往含有少量的氯化钠
产品往往含有少量的氯化钠 , 化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数。查阅资料知纯碱和稀盐酸反应,生成氯化钠、水和二氧化碳,他们取
, 化学兴趣小组的同学通过实验来测定该纯碱样品中纯碱的质量分数。查阅资料知纯碱和稀盐酸反应,生成氯化钠、水和二氧化碳,他们取 纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,无固体剩余,共消耗盐酸
纯碱样品放入烧杯中,逐滴加入稀盐酸至不再产生气泡为止,无固体剩余,共消耗盐酸 , 称得反应后溶液的质量为
, 称得反应后溶液的质量为 。则生成二氧化碳
。则生成二氧化碳  。样品中纯碱的质量分数为
。样品中纯碱的质量分数为  结果精确到
结果精确到 。
。
【考点】
验证质量守恒定律;
能力提升
真题演练











 测定空气中氧气的含量
测定空气中氧气的含量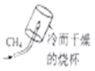 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律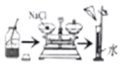 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液