1.
某兴趣小组用铁钉与硫酸铜溶液反应验证质量守恒定律时,发现铁钉表面有气泡产生、溶液没有变成浅绿色的异常现象,请你和兴趣小组一起探究,并回答问题。
【查阅资料】1.硫酸亚铁与氧气和水能发生反应,使得溶液中的氢离子浓度增加
2溶液中氢离子浓度越大,酸性越强
(1)
探究一:铁钉表面产生的是什么气体?
(2)
【进行实验】
(3)
【实验分析】
(4)
探究二:铁和硫酸铜溶液反应的最佳条件是什么?
(5)
探究三:反应中溶液pH值为什么减小?
(6)
【反思与交流】
【做出猜想】
猜想一:二氧化硫;猜想二:氧气;猜想三:氢气。
做出猜想的依据是。
实验步骤 | 实验现象 | 实验结论 |
①小芳用手在冒气泡的试管口轻轻扇动,使少量气体进入鼻孔 | 。 | 猜想一不正确 |
②小刚用带火星的木条伸入收集该气体的试管中 | 木条不复燃 | 猜想二不正确 |
③小明将收集该气体的试管移近酒精灯火焰,松开拇指 | 。 | 猜想三正确 |
硫酸铜溶液呈酸性,溶液中含有氢离子,该气体可看成由稀硫酸与铁钉反应产生的,请用化学方程式表示该气体产生的原因。
【实验探究】
分别用蒸馏水配置4%和2%的硫酸铜的冷、热溶液,各取5mL分别加入4支试管中,放入用砂纸打磨过的相同铁钉,比较反应现象,记录如下表:
实验编号 | 硫酸铜溶液 | 变为浅绿色 | 有红色固体 | 无气泡 | 符合标准现象 |
1 | 2%硫酸铜冷溶液 | √较慢 | √ | √ | √ |
2 | 2%硫酸铜热溶液 | √较快 | √ | √ | √ |
3 | 4%硫酸铜冷溶液 | √缓慢 | √ | √ | √ |
4 | 4%硫酸铜热溶液 | √较快 | √ | × | × |
①为探究反应物浓度对实验的影响,可选择实验进行对照(填实验编号)
②结合表格数据分析,铁和硫酸铜溶液反应的最佳条件是。
结合探究一中氢气产生的原理,兴趣小组的同学推测,随着反应的进行,溶液中氢离子浓度应该减小,pH值应该逐渐增大,于是利用如图1装置,用pH传感器测量溶液pH值的变化,同时测定了该装置中氧气含量的变化,结果如图2、图3所示,试分析溶液pH值下降的原因。



结合以上探究综合分析
①探究二中配置硫酸铜溶液的蒸馏水应该。
②利用铁与硫酸铜反应验证质量守恒定律时,应注意。
【考点】
验证质量守恒定律;
能力提升
真题演练









 测定空气中氧气的含量
测定空气中氧气的含量 探究甲烷中是否含碳元素
探究甲烷中是否含碳元素 验证质量守恒定律
验证质量守恒定律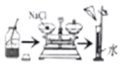 配制一定溶质质量分数的氯化钠溶液
配制一定溶质质量分数的氯化钠溶液