1.
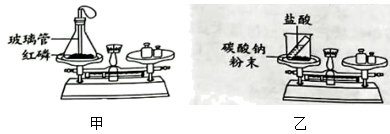
化学兴趣小组的同学设计了如下图实验装置(天平略)验证质量守恒定律。

(1)
A中气球的作用是,请写出A中发生反应的化学方程式为。
(2)
上述四个实验装置中,只有A能直接用于验证质量守恒定律,B、C、D装置则不能。
(3)
通过上述实验,同学们得出结论:当有气体参加或生成的反应,验证质量守恒定律必须在装置中进行。
(4)
从微观角度分析,在化学反应前后,一定不变的是(选填序号),所以质量守恒。
(5)
根据质量守恒定律推理,2021年从三星堆出土了大量表面有一层“绿色物质”的青铜器,研究人员将“绿色物质”隔绝空气加热,分解生成氧化铜、水和二氧化碳,由此得出该“绿色物质”一定由种元素组成。
B装置不能验证质量守恒定律的理由:。
C装置和D装置也不能验证质量守恒定律的理由:。
①原子种类 ②分子种类 ③原子数目 ④分子数目 ⑤原子质量 ⑥分子质量
【考点】
验证质量守恒定律;
质量守恒定律及其应用;
能力提升
真题演练