1.
五水合硫代硫酸钠(Na2S2O3 • 5H2O)俗称“海波”,常用作棉织物漂白后的脱氧剂、定量分析中的还原剂。
资料:① Na2S2O3 • 5H2O无色、易溶于水,难溶于乙醇;
② Na2S2O3在酸性溶液中反应有S和SO2产生
(一)制备
工业上可用SO2、Na2S和 Na2CO3制备Na2S2O3 • 5H2O,其工艺流程示意图如下:
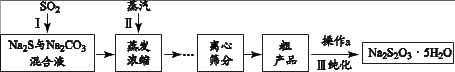
(1)
实验室可用浓硫酸与Cu反应制备SO2气体,该反应的化学方程式是。
(2)
① 配平I中反应的化学方程式: Na2S + SO2 + Na2CO3 = Na2S2O3 + CO2
(3)
II.粗产品提纯
(4)
III.纯度测定
② 当I中溶液的pH约为7时应停止通入SO2 , 否则Na2S2O3的产率下降,结合离子方程式说明其原因。
已知粗产品中可能会含有少量Na2SO3和Na2SO4 , Na2S2O3在水中的溶解度随温度的升高而显著增大。
① 检验粗产品中含有Na2SO4的方法是:取少量固体溶解, 先加足量的溶液,静置、过滤,,有白色沉淀生成。
② 粗产品的提纯过程III中,操作a的步骤为:加热溶解、趁热过滤、、过滤、(填洗涤试剂名称)洗涤、干燥。
准确称取a g产品于锥形瓶中,加入一定量蒸馏水完全溶解后,加入适量甲醛溶液预处理(防止Na2SO3与I2反应),以淀粉作指示剂,用c mol/L I2的标准溶液滴定,发生如下反应:I2 + 2S2O32- = 2I-+ , 三次平行实验,平均消耗v mL I2溶液。
(已知:Na2S2O3 • 5H2O的摩尔质量为248 g/mol )
① 产品中Na2S2O3•5H2O的纯度为 (写出质量分数的表达式即可)。
② 下列操作可能造成实验结果偏高的是。
A.滴定管未用I2标准溶液润洗
B.滴定终点时仰视读数
C.滴定过程中锥形瓶内有少量液体溅出瓶外
【考点】
氧化还原反应;
氧化还原反应方程式的配平;
物质的分离与提纯;
中和滴定;
探究物质的组成或测量物质的含量;
制备实验方案的设计;
能力提升

