1.
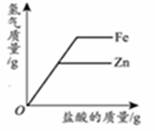
将一定质量的Fe粉加Mg(NO3)2和Cu(NO3)2的混合溶液中,充分反应后过滤,得滤渣和滤液。下列说法正确的是( )
A.
滤渣质量与加入的Fe粉质量可能相等
B.
滤液中一定有Mg(NO3)2、Fe(NO3)2 , 可能有Cu(NO3)2
C.
若加入的Fe粉过量,则得到的滤液呈无色
D.
若向滤渣中加入稀盐酸,有气泡生成,则滤渣中一定有Cu、Fe、Mg
【考点】
金属的化学性质;
金属活动性顺序及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练