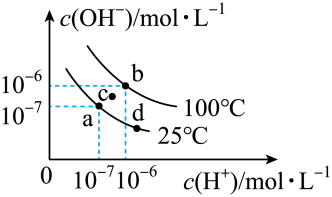
1.
90℃时水的离子积Kw=3.8×10-13 , 该温度时纯水的pH是( )
A.
等于7
B.
小于7
C.
大于7
D.
无法确定
【考点】
水的电离;
离子积常数;