1.
硫酸锌是制造锌钡白和锌盐的主要原料,口服硫酸锌可纠正锌缺乏,恢复酶系统的功能。用锌白矿(主要成分为ZnO,还含有 、
、 、
、 等杂质)制备
等杂质)制备 的流程如图:
的流程如图:
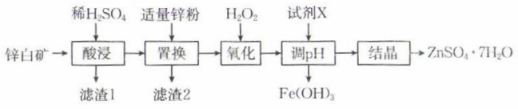
常温下,相关金属离子形成氢氧化物沉淀的pH如表所示(离子浓度小于mol⋅L
时视为沉淀完全):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
1.1 | 3.1 | |
7.6 | 9.6 | |
6.4 | 8.0 |
(1)
基态锌离子的价层电子轨道表示式为。
(2)
“酸浸”前通常需要将锌白矿粉碎,其目的是。
(3)
滤渣1的主要成分为(填化学式)。
(4)
加入 “氧化”时发生反应的离子方程式为。
(5)
加入试剂X调节溶液的pH在
“氧化”时发生反应的离子方程式为。
(5)
加入试剂X调节溶液的pH在 , 使铁元素转化为沉淀而除去,试剂X可以选用下列中的(填标号)。
(6)
pH过大时,锌元素会以
, 使铁元素转化为沉淀而除去,试剂X可以选用下列中的(填标号)。
(6)
pH过大时,锌元素会以 形式存在,则
形式存在,则 中存在的作用力为____(填标号)。
A.
离子键
B.
共价键
C.
σ键
D.
π键
中存在的作用力为____(填标号)。
A.
离子键
B.
共价键
C.
σ键
D.
π键
A.ZnO B. C.
根据题中数据计算常温下的溶度积
.
【考点】
原子核外电子排布;
化学键;
氧化还原反应;
难溶电解质的溶解平衡及沉淀转化的本质;
物质的分离与提纯;
能力提升

