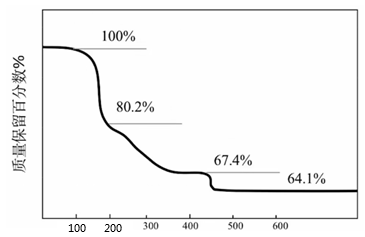
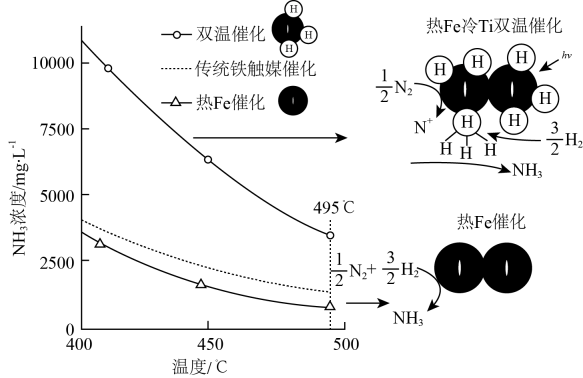
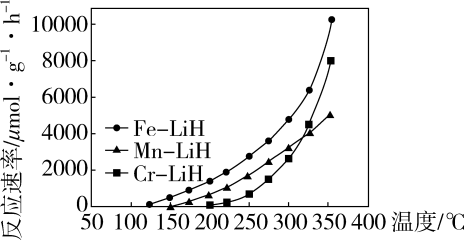
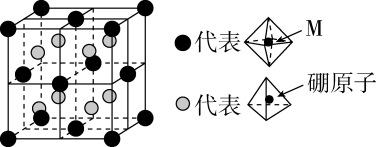
1.
原子结构与元素周期表存在着内在联系。根据已学知识,请你回答下列问题:
(1)
指出31号元素镓(Ga)在元素周期表中的位置:(写明第几周期第几族)。
(2)
第3周期元素的基态原子与基态Cu原子未成对电子数相同,且电负性最大的元素是。
(3)
在P区中,第2周期VA族元素原子电子的轨道表示式为:。
(4)
被誉为“21世纪的金属”的钛(Ti)元素原子的价电子排布式为:。
(5)
写出原子序数最小的Ⅷ族元素原子的核外电子排布式:。
(6)
写出3p轨道上有2个未成对电子的元素符号:。
(7)
日常生活中广泛应用的不锈钢,在其生产过程中添加了某种元素,该元素的价电子排布式为3d54s1 , 该元素的名称为:。
【考点】
原子核外电子排布;
能力提升
真题演练