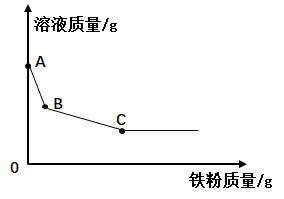
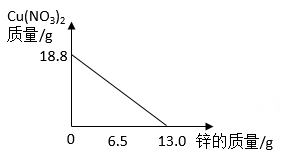
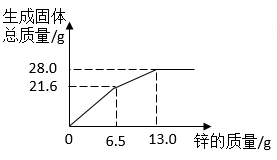
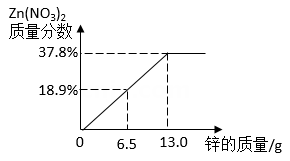
1.
某同学用足量的金属镁与7.3克5%的稀盐酸反应,测量产生氢气的体积。

(1)
已知氢气的密度比空气小,难溶于水。应选择甲图中的装置进行制取和收集。
(2)
乙图为检查发生装置气密性的操作,当观察到水中的导管口有产生,则表示该装置气密性良好。
(3)
已知氢气的密度为0.09克/升,请计算能收集到多少升氢气。(计算结果精确到0.01)
(4)
反应结束后,发现实际收集到的气体体积比计算值要大,请分析可能原因(写出两点)。
【考点】
金属的化学性质;
能力提升
真题演练