1.
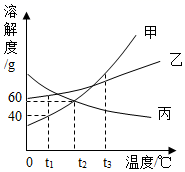
低钠盐是以碘盐为原料,再添加了一定量的氯化钾等物质。如图是氯化钠和氯化钾的溶解度曲线,下列说法正确的是( )

A.
20℃时,氯化钾溶液比氯化钠溶液的溶质质量分数大
B.
氯化钠和氯化钾都属于易溶物
C.
80℃时,将等质量的两种物质的饱和溶液降温到20℃,氯化钾析出晶体少
D.
80℃时,氯化钾饱和溶液中溶质质量分数为50%
【考点】
溶解度的影响因素;
固体溶解度曲线及其作用;
溶质的质量分数及相关计算;
基础巩固
能力提升
变式训练
拓展培优
真题演练