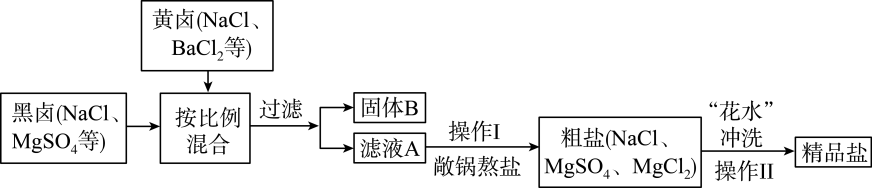
1.
粗盐中含有一定的可溶性杂质MgCl2、CaCl2和Na2SO4 , 为除掉杂质制得精盐需进行实验。
(1)
为除去上述粗盐水中的Na2SO4、CaCl2、MgCl2等杂质,需要依次加入过量的BaCl2、、NaOH溶液,分离出沉淀后,再加入适量盐酸后蒸发。
(2)
写出加入适量稀盐酸发生中和反应的化学方程式。
(3)
用提纯后的食盐配制一定质量分数的食盐水,若用量筒量取水时仰视读数,则配制的溶液的溶质质量分数(填“偏大”“偏小”或“不变”)。
【考点】
粗盐提纯;
物质除杂或净化的探究;
能力提升
真题演练