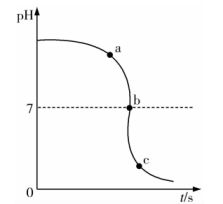
1.
奥运五环的蓝、黄、黑、绿和红色象征欧、亚、非、大洋、美五大洲和全世界的运动员在奥运会上相聚一堂。若要用化学试剂给如下有凹槽的塑料奥运五环加上颜色(注:所给试剂恰好完全反应或完全溶解,凹槽可盛放溶液),你认为合理的是( )

A.
用铜粉末和稀硫酸给蓝环上色
B.
用铁粉和稀盐酸给黄色环上色
C.
用氧化铁和稀盐酸给绿环上色
D.
用氢氧化钠和酚酞给红环上色
【考点】
酸与碱的反应及用途;
酸的化学性质;
碱的化学性质;