1.
硫酸铜是一种重要物质。
(1)
波尔多液是一种农业上常用的杀菌剂,它由硫酸铜、生石灰加水配制而成。
(2)
兴趣小组同学在做硫酸铜和氢氧化钠反应的实验时,发现滴加试剂的顺序不同会产生不同的现象。
(3)
【实验探究】将实验二反应后的物质过滤、洗涤、低温干燥得浅蓝绿色固体样品。小组同学称取27.6g样品,在老师的指导下进行实验。
(4)
【拓展延伸】在烧杯中放入20mL某硫酸铜溶液,逐滴加入某浓度的氢氧化钡溶液,测定混合液pH随滴入Ba(OH)2溶液体积的变化,结果如图。下列说法正确的是(填字母)。
①写出生石灰与水生成熟石灰后,再与硫酸铜反应的两个化学方程式:、。
②果蔬表面残留的波尔多液不易用水洗去,浸泡时可在水中加点(填字母)浸泡除去。
A、食醋 B、食盐 C、纯碱 D、植物油

【查阅资料】Ⅰ、NaOH和CuSO4溶液混合可生成Cu(OH)2、Cux(OH)y(SO4)z等多种产物。
Ⅱ、68℃时,Cu(OH)2发生分解;300℃左右Cux(OH)y(SO4)z发生分解。
【思考交流】实验一中加热时发生反应的化学方程式为。

①装配好装置后,装药品前要进行的操作是。
②控制温度为68℃,对样品进行热分解,至固体质量不再减少,再通一段时间N2。冷却后测得装置B增重1.8g。
A、再通一段时间N2的目的是。
B、样品中Cu(OH)2的质量为。
③取出装置A中加热后的剩余固体,溶于适量稀盐酸完全溶解后,再向溶液中加入过量BaCl2溶液,得11.65g沉淀;继续加入过量NaOH溶液,沉淀质量增加了24.5g。则Cux(OH)y(SO4)z中x:y:z=。

A、硫酸铜溶液呈酸性 B、a点烧杯内溶液中溶质是硫酸铜
C、b点烧杯内物质几乎不导电 D、bc段烧杯内沉淀质量不断增加
【考点】
酸的化学性质;
溶液的酸碱性与pH值的关系;
能力提升
真题演练
 图2
图2 图3
图3
 图5
图5

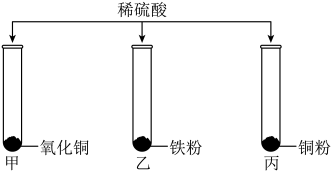

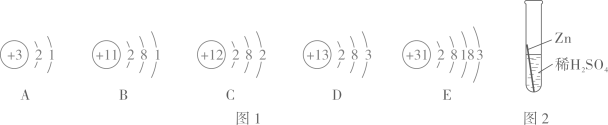
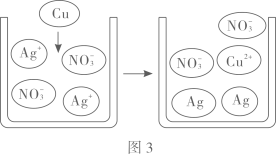
 向一定质量的氢氧化钠溶液中不断加入稀盐酸
向一定质量的氢氧化钠溶液中不断加入稀盐酸 向一定质量的稀盐酸和氯化铜的混合溶液中逐滴滴加氢氧化钠溶液
向一定质量的稀盐酸和氯化铜的混合溶液中逐滴滴加氢氧化钠溶液 向等质量的铁粉和锌粉中分别逐滴滴加等质量分数的稀硫酸至过量
向等质量的铁粉和锌粉中分别逐滴滴加等质量分数的稀硫酸至过量 在密闭容器中,引燃镁条
在密闭容器中,引燃镁条