1.
为研究稀硫酸的化学性质,某小组如图所示进行实验,充分反应后,只有试管甲中无固体剩余。
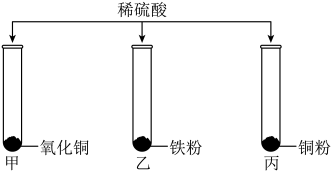
(1)
实验涉及的三种固体中,属于氧化物的是;
(2)
可证明铁的金属活动性比铜强的实验是(选填试管编号)。
(3)
甲中发生反应的化学方程式是。
(4)
实验结束后,将三支试管中的剩余物倒入废液缸中,充分混合后过滤,取少量滤渣,向其中滴加稀硫酸,有气泡产生。则过滤后得到的滤渣的成分是,滤液中的溶质是。
【考点】
酸的化学性质;
能力提升
真题演练
 图2
图2 图3
图3
 图5
图5


