1.
某化学小组在研究Na2SO3溶液、FeCl3溶液性质及反应时,进行了下列实验:
(1)
取1mol•L﹣1的Na2SO3溶液置于空气中,测得其pH随时间的变化曲线如图所示:
(2)
探究Na2SO3溶液与FeCl3溶液实际反应的情况:
(3)
资料显示:Fe2+呈淡绿色、FeSO3是墨绿色沉淀、碱式硫酸铁[Fe4(OH)2(SO4)5]溶液为红褐色.
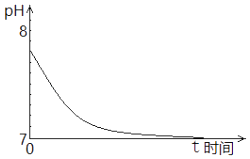
①最初,Na2SO3溶液pH=7.8,解释其原因的离子方程式是.
②t时间段内,造成其pH发生上述变化,用离子方程式解释是.
实验ⅰ
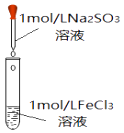
装置 | 操作 | 现象 |
| 向2mL1mol•L﹣1FeCl3溶液中,逐滴滴加1mo•L﹣1Na2SO3溶液2mL | 溶液黄色逐渐加深,最终得红褐色溶液(W) |
实验ⅱ
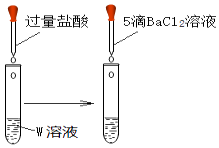
装置 | 操作 | 现象 |
| 取1mL溶液W于试管中,向其滴加过量盐酸,再滴加5滴BaCl2溶液 | 产生白色沉淀 |
①实验ⅱ证明,溶液中含有离子;
②对Na2SO3溶液与FeCl3溶液实际反应存在两种认识:
认识Ⅰ.反应中Fe3+完全转化为Fe2+ , W溶液中c(Fe2+)一定很大,反应的离子方程式是.
认识Ⅱ.W溶液中c(Fe2+)应该极小,否则W溶液不会呈红褐色.
①实验中始终未出现墨绿色沉淀,说明c(Fe2+)极小,其原因用离子方程式解释是.
②实验过程和结果显示,O2、Fe3+、SO42﹣的氧化性强弱顺序是.
③若Fe4(OH)2(SO4)5是造成溶液W呈红褐色的原因之一,其形成的化学方程式是.
④用激光笔照射W溶液,发现有丁达尔现象,用离子方程式解释原因是.
【考点】
性质实验方案的设计;
能力提升
真题演练