1.
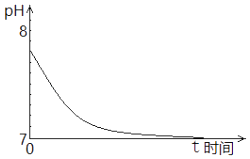
硫酸亚铁铵[(NH4)2Fe(SO4)2•6H2O]是分析化学中重要的试剂,学习小组探究其分解产物.
(1)
甲组按照图1所示的装置进行实验,关闭止水夹并加热A中的硫酸亚铁铵固体至分解完全,检验其分解产物.
(2)
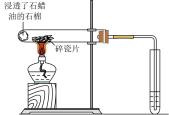
乙组选用甲组实验中的装置A和图2所示的装置进行实验验证硫酸亚铁铵分解的产物中还有SO2和SO3 .
(3)
丙组将一定量的硫酸亚铁铵在500℃时隔绝空气加热一段时间后检验其固体产物,请设计实验证明:此固体产物不含二价铁:.

①装置B仪器名称是,所放试剂是.
②装置C中可观察到的现象是,由此可知硫酸亚铁铵的分解产物中有.(写化学式)
①乙组同学的实验装置中,依次连接的合理顺序(用装置的字母表示)为A、;取适量硫酸亚铁铵固体于A中,通入一段时间N2后,关闭止水夹再点燃酒精灯,通入N2的目的是.
②装置H中有白色沉淀,则证明分解产物中有;G中发生反应的离子方程式为.
【考点】
性质实验方案的设计;
能力提升
真题演练