1.
某班同学取用相同总质量的木炭粉和氧化铜的混合物,按图示装置进行实验。实验过程中发现有的小组“黑色固体变红色”这一实验现象不明显。小组同学对此异常现象进行如下探究。 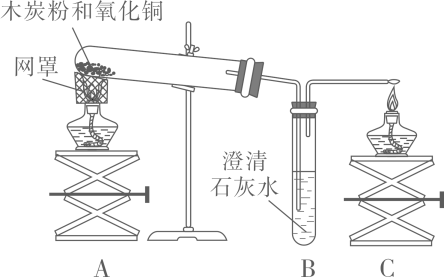

(1)
(知识回忆)碳和氧化铜反应的化学方程式为  ,理论上碳和氧化铜的质量比为。
(2)
(作出猜想)产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
,理论上碳和氧化铜的质量比为。
(2)
(作出猜想)产生异常现象可能与所取用木炭粉和氧化铜的质量比有关。
(3)
(反思评价)分析发现,实验5中m(C):m(CuO)比值与理论值不符,实验后却无黑色固体残留。请用化学方程式解释实验中过量的黑色固体消失的原因:(写一个即可)。
(实验探究)小组同学用总质量相同但质量比不同的木炭粉和氧化铜的混合物(不考虑其中杂质),分别进行实验,部分实验现象记录如下:
|
实验序号1 |
m(C):m(CuO) |
实验后A处试管中固体颜色 |
C处导管口的现象 |
|
1 |
1:8 |
红色固体中有少量黑色固体 |
尾气燃烧 |
|
2 |
1:9 |
红色固体中有较少量黑色固体 |
尾气燃烧 |
|
3 |
1:10 |
红色固体中有很少量黑色固体 |
尾气不燃烧 |
|
4 |
1:11 |
红色固体中有极少量黑色固体 |
|
|
5 |
1:12 |
红色固体中无黑色固体 |
尾气不燃烧 |
|
6 |
1:13 |
红色固体中有较多黑色固体 |
尾气不燃烧 |
(交流讨论)
①推测实验4中“C处导管口的现象”是。
②上述探究可得出,实验时所用木炭粉和氧化铜的质量比控制在1:10~1:12之间,可观察到黑色固体明显变红,同时还可减少(填化学式)排放,防止空气污染。
③检验实验6反应后A处试管中黑色固体物质,可滴加的试剂是,观察到的现象是。
【考点】
碳、一氧化碳、氢气还原氧化铜实验;
实验探究物质的性质或变化规律;
能力提升
真题演练




