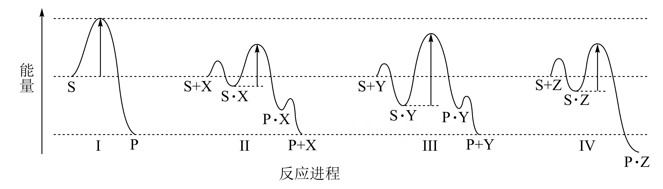
1.
H2在Cl2中燃烧时产生苍白色火焰.已知断裂1mol H2中的化学键消耗的能量为436kJ,断裂1mol Cl2中的化学键消耗的能量为243kJ,形成1mol HCl中的化学键释放的能量为432kJ.对于反应H2+Cl2=2HCl,当1molH2发生反应时,反应放出的热量为 kJ.说明1mol H2与1mol Cl2的总能量 2mol HCl的总能量(填“高于”或“低于”).
【考点】
化学反应中能量的转化;
基础巩固
能力提升
变式训练
拓展培优
真题演练