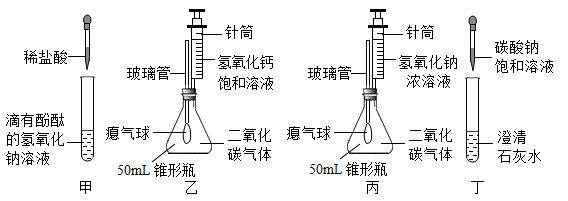
1.
Na2SO4是制造纸张、药品、染料稀释剂等的重要原料。某Na2SO4样品中含有少量CaCl2和MgCl2 , 实验室提纯Na2SO4的流程如图所示。

(1)
操作a的名称是。
(2)
加入NaOH溶液可除去的是,其反应的化学方程式为:。若添加的NaOH溶液和Na2CO3溶液过量,可加入适量(填“稀盐酸”或“稀硫酸”)除去。
【考点】
碱的化学性质;
酸碱盐的溶解性;
物质除杂或净化的探究;
物质的相互转化和制备;
能力提升