1.
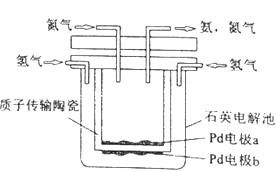
芒硝化学式为Na2SO4•10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
①该电解槽的阳极反应式为.此时通过阴离子交换膜的离子数(填“>”、“<”或“=”)通过阳离子交换膜的离子数.
②制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)导出.
③通电开始后阴极附近溶液pH会 (填“增大”、“减小”或“不变”).
④若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池.已知H2的燃烧热为285.8kJ•mol﹣1则该燃料电池工作产生36g H2O时理论上有 kJ的能量转化为电能.

【考点】
电解原理;
能力提升
变式训练
拓展培优
真题演练