1.
合理利用碳氢化合物以及二氧化碳捕集、存储和转化是当今化学研究的热点问题之一.

(1)
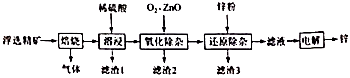
将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒).持续通入甲烷,在标准状况下,消耗甲烷体积0<V<44.8L时,负极电极反应为;
(2)
若以该燃料电池作为电源,用石墨作电极电解500mL 饱和食盐水,当两极共收集到标准状况下的气体1.12L(以不考虑气体的溶解)时,所得溶液的pH=(假设反应前后溶液体积不变).
【考点】
电解原理;
能力提升
真题演练