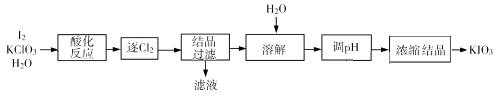
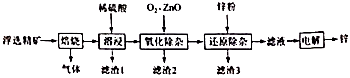
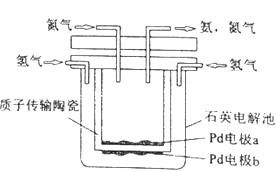
1.
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾.为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品.请按要求回答下列问题:

(1)
硫酸工厂尾气中的SO2通常用足量石灰水吸收,然后再用稀硫酸处理.
(2)
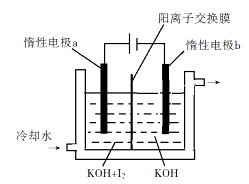
某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法;其中阴阳膜组合循环再生机理如图所示,a、b离子交换膜将电解槽分为三个区域,电极材料为石墨.
①写出上述过程反应的化学方程式:
②请说出这种尾气处理方法的优点(说出两点即可):
③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等还原性物质,其目的是
①图中a表示 离子交换膜(填“阴”或“阳”).A~E分别代表生产中的原料或产品,其中C是硫酸,则A是 ,E是 .
②阳极的电极反应式为
【考点】
电解原理;
能力提升
真题演练