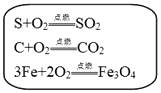
1.
示例:硫在空气、氧气中燃烧,化学反应相同,但反应现象不同.说明反应物的浓度不同,反应现象不同.请参照示例回答下列问题:
(1)碳在氧气不足、氧气充足的条件下燃烧,反应物相同,但产物不同.说明不同,产物不同.
(2)二氧化碳与水反应,在常温下生成碳酸,在叶绿体、光照的条件下发生光合作用生成葡萄糖和氧气.反应物相同,但产物不同.说明不同,产物不同.
(3)细铁丝(或铁粉)在氧气中能剧烈燃烧,铁钉(或铁制燃烧匙)在氧气中不能燃烧,反应物相同,但反应的速率不同.说明反应物的不同,反应的速率不同.
【考点】
氧气的性质和利用;