1.
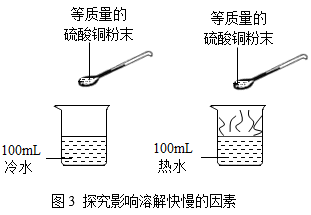
在化学实验中,很多因素对实验现象成结果都有影响。
(1)
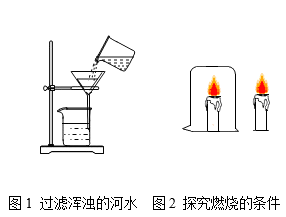
请举例说明反应物的浓度不同,反应现象不同。
(2)
相同温度下,碘分别在等量的水和汽油中溶解性不同,这个实例说明了什么?
【考点】
影响化学反应速率的因素探究;
能力提升
真题演练