1.
(14分)随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

(1)
f在元素周期表的位置是 。
(2)
比较d、e常见离子的半径的小(用化学式表示,下同) > ;比较g、h的最高价氧化物对应的水化物的酸性强弱是: > 。
(3)
任选上述元素组成一种四原子共价化合物,写出其电子式 。
(4)
已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: 。
(5)
上述元素可组成盐R:zx4f(gd4)2 , 向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下:

①R溶液中离子浓度由大到小的顺序是: 。
②写出m点反应的离子方程式 。
③若R溶液改加20mL1.2 mol·L-1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为 mol。
【考点】
盐类水解的原理;
影响盐类水解程度的主要因素;
盐类水解的应用;
能力提升
真题演练

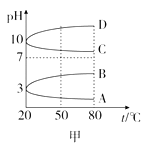

 下列分析错误的是( )
下列分析错误的是( )