1.
亚铁离子是一种重要的金属阳离子,在化工、医药、农业等领域有广泛的用途。
(1)
[Fe(H2O)6]2+是一种常见催化剂,能催化臭氧(O3)与烟气(SO2、NOx)的反应。
(2)
绿矾(FeSO4·7H2O)的结构如图,键角∠1、∠2、∠3由大到小的顺序是。加热时,图中(填“a”或“b”)号位的水分子更容易失去。
(3)
某补铁剂的主要成分为琥珀酸亚铁,可用邻二氮菲测定Fe2+的含量,适宜pH范围为2~9,反应原理为 (红色),邻二氮菲(phen)结构简式如图。
(红色),邻二氮菲(phen)结构简式如图。
①O、N、S元素的第一电离能由大到小的顺序为。
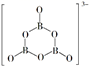
②请写出一种与互为等电子体的分子。
③[Fe(H2O)6]2+吸收NO生成[Fe(NO)(H2O)6]2+ , 画出生成的[Fe(NO)(H2O)6]2+的结构简式,并用“→”标出所有配位键:。


①[Fe(phen)3]2+中,Fe2+的配位数为,邻二氮菲中N原子的孤电子对占据轨道。
②测定Fe2+浓度时,加入盐酸使溶液pH不断减小,红色逐渐变浅。从化学键角度分析原因:。
【考点】
元素电离能、电负性的含义及应用;
配合物的成键情况;
“等电子原理”的应用;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练