1.
硼、砷等元素可形成结构、性质各异的物质,在生产、科研中发挥着重要用途。回答下列问题:
(1)
BF3与一定量的水形成 , 一定条件下
, 一定条件下 可发生如下转化:
(2)
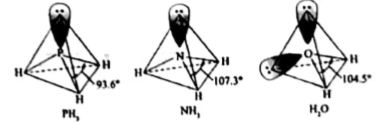
基态砷原子的价层电子排布式为。沸点:CH3As(OH)2(CH3)2AsOH(填“>”或“<”或“=”),原因是。
(3)
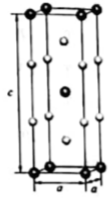
LiZnAs晶体的立方晶胞结构如图1所示,M点原子分数坐标为
可发生如下转化:
(2)
基态砷原子的价层电子排布式为。沸点:CH3As(OH)2(CH3)2AsOH(填“>”或“<”或“=”),原因是。
(3)
LiZnAs晶体的立方晶胞结构如图1所示,M点原子分数坐标为 ;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。
;LiZnAs晶体部分Zn原子被Mn原子代替后可以形成一种新型稀磁半导体LiZnmMnnAs,其立方晶胞结构如图2所示。

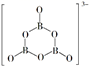
①熔化后,R中阴离子存在的化学键有(填选项字母)。
a.离子键 b.非极性共价键 c.配位键
d.极性共价键 e.氢键
②多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,则B-F的键长:BF3 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。

①N点原子分数坐标为。
②n=。
③已知NA为阿伏加德罗常数的值,LiZnmMnnAs的摩尔质量为Mg·mol-1 , 晶体密度为dg·cm-3。晶胞中两个Zn原子之间的最短距离为nm(列出计算式)。
【考点】
配合物的成键情况;
晶胞的计算;
氢键的存在对物质性质的影响;
能力提升
真题演练