1.
氮、硫和氯等是构成化合物的常见元素。已知:2SO3+H2O= 。
。
 。
。
(1)
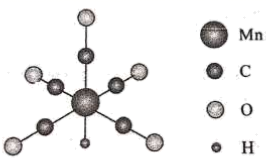
某化合物的晶胞如图所示,其化学式是, 周围最近的
周围最近的 有个,晶体类型是。
(2)
下列说法正确的是___________。
A.
能量最低的激发态Cl原子的M层电子排布图为
有个,晶体类型是。
(2)
下列说法正确的是___________。
A.
能量最低的激发态Cl原子的M层电子排布图为 B.
电负性:
B.
电负性: C.
C.
 中两个
中两个 键的镜面在空间上相互垂直
D.
第一电离能:
键的镜面在空间上相互垂直
D.
第一电离能: (3)
①
(3)
① 和
和 发生如下过程:
发生如下过程: , 硫酸起到(填“酸”、“碱”)的作用。
(4)
将
, 硫酸起到(填“酸”、“碱”)的作用。
(4)
将 与
与 发生化合反应生成
发生化合反应生成 型离子化合物,其中A为
型离子化合物,其中A为 , 写出B的结构式。
, 写出B的结构式。

 B.
电负性:
B.
电负性:比较键角 ,
(填“>”、“<”或“=”),理由是。
【考点】
元素电离能、电负性的含义及应用;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练