1.
过渡元素在材料和化工生产中占有重要地位。
(1)
 中的化学键具有明显的共价性,蒸气状态下以双聚分子存在(
中的化学键具有明显的共价性,蒸气状态下以双聚分子存在( ),写出氯化铁双聚分子的结构式。
(2)
元素Mn和Fe的部分电离能如下表所示,发现Mn元素的第三电离能(
),写出氯化铁双聚分子的结构式。
(2)
元素Mn和Fe的部分电离能如下表所示,发现Mn元素的第三电离能( )要大于Fe元素的第三电离能,原因是。
)要大于Fe元素的第三电离能,原因是。
(3)
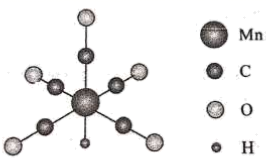
Mn的一种配合物化学式为 , 下列说法正确的是___________。
A.
, 下列说法正确的是___________。
A.
 与Mn原子配位时,提供孤电子对的是C原子
B.
电负性:H<C<N<O
C.
与Mn原子配位时,提供孤电子对的是C原子
B.
电负性:H<C<N<O
C.
 中两个C原子的杂化类型均为
中两个C原子的杂化类型均为 D.
D.
 中σ键与π键数目之比为5:2
(4)
某晶体
中σ键与π键数目之比为5:2
(4)
某晶体 的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe,
的晶胞如图1所示,Cu可以完全取代该晶体中a位置Fe或b位置Fe, 转化为两种Cu替代型产物的能量变化如图2所示。
转化为两种Cu替代型产物的能量变化如图2所示。
元素 | Mn | Fe | |
电离能 ( | 717 | 759 | |
1509 | 1561 | ||
3248 | 2957 | ||

①其中相对不稳定的Cu替代型产物的化学式为。
②下列关于晶体的说法正确的是。
A.晶体的形成与晶体的自范性有关
B.测定某一固体是否属于晶体可以用X-射线衍射仪进行实验
C.晶体和非晶体的根本区别在于固体是否有规则的几何外形
D.由玻璃制成规则的玻璃球体现了晶体的自范性
E.晶胞是晶体结构中最小的重复单元
【考点】
元素电离能、电负性的含义及应用;
晶胞的计算;
能力提升
真题演练