1.
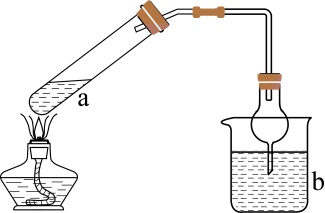
氯化氰 , 又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:
, 又名氯甲氰,是重要的化工中间体,在农药、医药、化工助剂等方面有着广泛的应用。某小组制备氯化氰并探究其性质,装置如图所示。回答下列问题:

已知部分信息如下:
①CNCl的熔点为-6.5℃,沸点为13.1℃,可溶于水并与水反应;具有较强的还原性。
②合成原理:在℃条件下,
。
(1)
 所含元素中第一电离能最大的是(填元素符号),B的作用是。
(2)
F中干冰和丙酮的作用是降低温度,此时干冰(填“升华”或“凝华”)。
(3)
实验中,先向D中通入(填“
所含元素中第一电离能最大的是(填元素符号),B的作用是。
(2)
F中干冰和丙酮的作用是降低温度,此时干冰(填“升华”或“凝华”)。
(3)
实验中,先向D中通入(填“ ”或“
”或“ ”)。
(4)
D中温度高于-5℃时,
”)。
(4)
D中温度高于-5℃时, 与
与 反应只生成
反应只生成 和气体X(纯净物,其结构中不含环状结构),X的电子式为。当G中(填实验现象)时,停止通入
和气体X(纯净物,其结构中不含环状结构),X的电子式为。当G中(填实验现象)时,停止通入 。
(5)
本实验在通风橱中进行且操作者佩戴防毒面具,原因是。向盛有
。
(5)
本实验在通风橱中进行且操作者佩戴防毒面具,原因是。向盛有 溶液的试管中通入少量
溶液的试管中通入少量 , 然后滴加一滴
, 然后滴加一滴 溶液,溶液立即变为红色,
溶液,溶液立即变为红色, 和
和 反应的离子方程式为。
(6)
上述实验中,
反应的离子方程式为。
(6)
上述实验中, 完全反应时收集到
完全反应时收集到
 , 产率为%(结果保留整数)。
, 产率为%(结果保留整数)。
【考点】
化学实验方案的评价;
能力提升
真题演练