1.
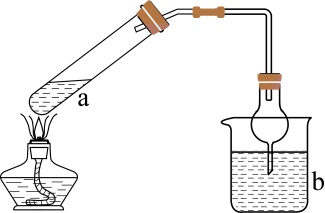
利用传统方式制备乙炔的过程中,存在一些问题难以解决,如反应速率过快、放热过多不易控制,生成的糊状物难以实现固液分离导致乙炔气流不平稳,甚至发生堵塞等问题。为解决上述问题,某校化学兴趣小组设计出一套乙炔制备、净化和收集实验的一体化实验装置。

(1)
实验室常用电石与水反应的传统方法制取乙炔,写出反应的化学方程式:。
(2)
①仪器B的名称是;
(3)
兴趣小组在制备乙炔时对反应液进行了一系列筛选(如下图),依据图表选择最合适的反应液为(填标号),原因是。
(4)
选取合适的反应液后,小组称取电石 (杂质的质量分数为
(杂质的质量分数为 )完成实验,除杂后测得乙炔气体体积为
)完成实验,除杂后测得乙炔气体体积为 (标准状况下),计算该实验中乙炔的产率:
(标准状况下),计算该实验中乙炔的产率: (结果保留两位有效数字)。
(结果保留两位有效数字)。
②向反应器中填装固体反应物时,电石放置位置为(填“甲处”或“乙处”);反应器中装有
玻璃珠,其作用为;
③B装置中可用次氯酸钠吸收混杂在乙炔中的 , 反应中
被氧化为最高价氧化物对应的水化物,请写出次氯酸钠与
反应的离子方程式:。
a.饱和食盐水 b.醋酸 c.
盐酸 d.饱和氯化铵溶液

【考点】
化学实验方案的评价;
能力提升
真题演练