1.
丙烯腈 是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与
是合成纤维、合成橡胶和合成树脂的重要单体,可以由乙炔与 反应制得。原理为
反应制得。原理为
(1)
I.制备催化剂 (2)
用恒压滴液漏斗分批多次滴加
(2)
用恒压滴液漏斗分批多次滴加 , 且
, 且 过量,原因是。
(3)
方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为。
(4)
Ⅱ.合成丙烯腈
(5)
上述制备乙炔过程中,B装置的作用是。
(6)
装置D中可盛放的溶液是____。
A.
饱和食盐水
B.
过量,原因是。
(3)
方案2燃烧后的固体溶于水,过滤后发现一些白色固体X,为检测X的成分,某同学将其溶于稀硫酸,白色固体变为红色,且溶液呈蓝色,推测X为。
(4)
Ⅱ.合成丙烯腈
(5)
上述制备乙炔过程中,B装置的作用是。
(6)
装置D中可盛放的溶液是____。
A.
饱和食盐水
B.
 溶液
C.
高锰酸钾溶液
D.
盐酸溶液
(7)
工业用
溶液
C.
高锰酸钾溶液
D.
盐酸溶液
(7)
工业用 含
含 质量分数
质量分数 的电石,生产得到丙烯腈
的电石,生产得到丙烯腈 , 产率为。
, 产率为。
通过查阅资料有两种方案可以制备:
方案1:铜屑与在浓盐酸中反应;
方案2:铜丝在氯气中燃烧。
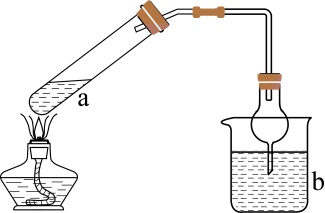
方案1的实验原理如图所示。

①仪器a的名称:。
②请写出方案1的反应原理:(用离子方程式表达)。
已知:①电石的主要成分是 , 还含有少量硫化钙;
②HCN易挥发,有毒,具有较强的还原性。

的电子式:。
【考点】
化学实验方案的评价;
能力提升
真题演练