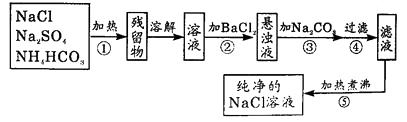
1.
某混合气体由CO、CO2、SO2三种气体组成,某兴趣小组对此进行了相关实验:
【查阅资料】①SO2能使品红溶液褪色;②SO2易与高锰酸钾溶液反应而被吸收,并能使其褪色;③SO2能使氢氧化钡溶液和澄清石灰水变浑浊;④CO和CO2均不能使品红溶液褪色,也不与高锰酸钾溶液反应。
【实验研究】为验证这三种气体,同学们设计并进行如下实验:
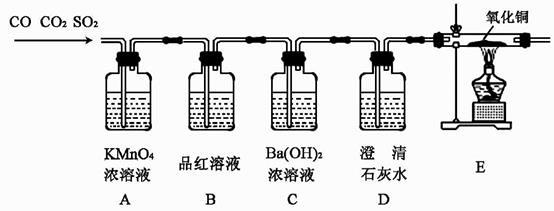
【事实与结论】通过实验验证了以上三种气体都存在。
(1)
装置A的作用是。
(2)
能证明气体中含有CO2的现象是。
(3)
【反思与评价】若装置按C→D→A→B→E的顺序连接,则无法验证的气体是。
(4)
有同学提出上述原装置中省略D装置也能达到实验目的,你认为该同学的设计有无道理并说明理由。
【考点】
物质除杂或净化;
能力提升
真题演练