1.
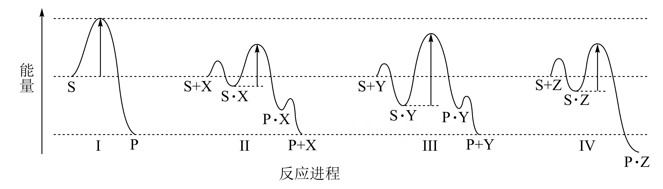
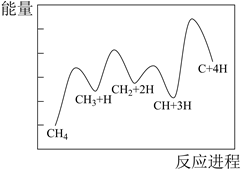
已知H2O(g) = H2(g) +  O2(g),反应过程中能量变化如图所示。请回答下列问题:
O2(g),反应过程中能量变化如图所示。请回答下列问题:

(1)
图中a表示;
(2)
该反应ΔH 0(填“<”或“>”)。
【考点】
活化能及其对化学反应速率的影响;