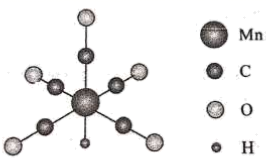
1.
(1)
第一电离能介于B、N之间的第二周期元素有种.
(2)
CH4中共用电子对偏向C,SiH4中硅元素为+4价,则C、Si、H的电负性由大到小的顺序为。
(3)
Fe3C晶体中碳元素为-3价,则其中基态铁离子的电子排布式为。
(4)
甲醇(CH3OH)分子内的O-C-H键角(填“大于”、“等于”或“小于”)甲醛(H2C=O)分子内的O-C-H键角。
(5)
BF3和NF3都是四个原子的分子,BF3分子的立体构型是平面三角形,而NF3分子的立体构型是三角锥形的原因是。
(6)
测定大气中PM2.5的浓度方法之一是β-射线吸收法,β-射线吸收法可用85Kr.Kr晶体为面心立方晶体,若晶体中与每个Kr原子相紧邻的Kr原子有m个,晶胞中含Kr原子为n个,则  =(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
=(填数字)。已知Kr晶体的密度为ρg/cm3 , 摩尔质量为Mg/mol,阿伏加德罗常数用NA表示,列式表示Kr晶胞参数a=_nm。
【考点】
原子核外电子排布;
元素电离能、电负性的含义及应用;