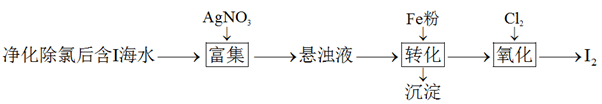
1.
阅读下列材料,完成下面小题。
含氯化合物在生产生活中应用广泛。实验室用氯酸钾、二氧化锰等强氧化剂和浓盐酸反应制备氯气;工业上用电解饱和食盐水的方法制备 , 同时生成NaOH、
。工业上用钢瓶储运液氯。
具有强氧化性,一定条件下可以氧化某些金属单质和非金属单质,还可以与水反应生成盐酸和次氯酸。工业上利用
生产盐酸、“84”消毒液、漂白粉等。
(1)
下列反应方程式及说法均正确的一组是
A.
氯酸钾与浓盐酸反应制氯气的化学方程式为 (浓)
(浓) ;每生成3个
;每生成3个 时,共转移6个电子
B.
电解饱和食盐水制氯气的离子方程式为
时,共转移6个电子
B.
电解饱和食盐水制氯气的离子方程式为 ;
; 是还原剂
C.
氢气在氯气中燃烧的化学方程式为
是还原剂
C.
氢气在氯气中燃烧的化学方程式为 ;发出苍白色火焰,集气瓶上方出现白雾
D.
工业上制漂白粉的化学方程式为
;发出苍白色火焰,集气瓶上方出现白雾
D.
工业上制漂白粉的化学方程式为 ;漂白粉可以作游泳池的消毒剂
(2)
取一个收集满氯气的集气瓶做如图1的实验:先添加适量的蒸馏水,盖上塞子振荡,然后用注射器滴加NaOH溶液,再用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。(加入的NaOH溶液和稀盐酸的体积对压强产生的影响忽略不计)下列说法不正确的是
;漂白粉可以作游泳池的消毒剂
(2)
取一个收集满氯气的集气瓶做如图1的实验:先添加适量的蒸馏水,盖上塞子振荡,然后用注射器滴加NaOH溶液,再用注射器滴加稀盐酸,用压强传感器测得集气瓶内的压强随时间变化的曲线如图2所示。(加入的NaOH溶液和稀盐酸的体积对压强产生的影响忽略不计)下列说法不正确的是 溶于水的过程,溶于水的
溶于水的过程,溶于水的 可全部与水反应
B.
阶段②的压强变小,说明
可全部与水反应
B.
阶段②的压强变小,说明 可被NaOH溶液吸收
C.
阶段②之后有气体生成,且该气体是氯气
D.
若将
可被NaOH溶液吸收
C.
阶段②之后有气体生成,且该气体是氯气
D.
若将 换成
换成 , 所得的压强变化趋势可能与图2相似
, 所得的压强变化趋势可能与图2相似

【考点】
氧化还原反应方程式的配平;
能力提升
真题演练