1.
反应
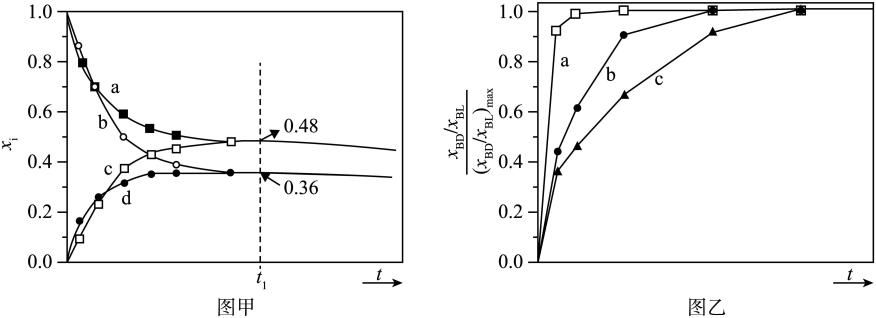
 , 在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段中各物质浓度随时间变化的曲线如图所示:
, 在恒容条件下进行。改变反应条件,在Ⅰ、Ⅱ、Ⅲ阶段中各物质浓度随时间变化的曲线如图所示:

(1)
化学方程式中a:b:c=。
(2)
A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A)从大到小的排列顺序为。
(3)
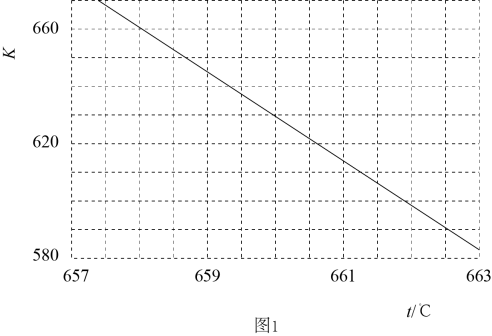
B的平衡转化率αⅠ(B)、αⅡ(B)、αⅢ(B)中最小的是,其值是%(保留2位有效数字)
(4)
由第一次平衡到第二次平衡,平衡向(填“左”或“右”)移动,采取的措施是。
(5)
其他条件不变,只改变温度,则第Ⅱ阶段反应温度(T2)第Ⅲ阶段反应温度(T3)(填“<”或“>”或“=”),理由。
【考点】
化学平衡的计算;
能力提升
真题演练