1.
几种弱酸的电离常数(25℃)如下表:
弱酸 | |||
电离常数 |
(1)
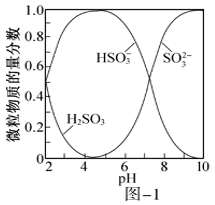
将少量 通入
通入 溶液中的离子方程式为。
(2)
常温下,一定浓度的
溶液中的离子方程式为。
(2)
常温下,一定浓度的 溶液的
溶液的 , 溶液中
, 溶液中 。
(3)
对
。
(3)
对

 溶液进行下列操作,能使
溶液进行下列操作,能使 的水解程度增大的是_______(填标号)。
A.
适当升高温度
B.
加入
的水解程度增大的是_______(填标号)。
A.
适当升高温度
B.
加入 固体
C.
通入
固体
C.
通入 气体
D.
加入
气体
D.
加入 固体
(4)
用实验确定
固体
(4)
用实验确定 是否为弱电解质,设计了如下实验方案:
是否为弱电解质,设计了如下实验方案:
①方案1:先量取一定体积的 , 配制成
的溶液,用pH计测出常温下该溶液的pH的值,证明
为弱电解质。
②方案2:设计一个合理且比较容易进行的实验方案(药品可任取),并作简明扼要的表述:。
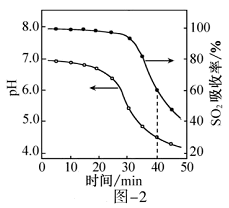
③25℃时,用pH计测定不同浓度溶液的pH如图所示,稀释
溶液,水的电离程度会(填“增大”或“减小”),根据图中信息,判断
为弱电解质的依据是。

【考点】
弱电解质在水溶液中的电离平衡;
盐类水解的应用;
能力提升
真题演练