1.
甲酸是重要化工原料,在新能源领域应用潜力大,对环保和可持续发展也很重要。
(1)
根据以下信息,写出甲酸分解制氢的热化学方程式:。
(2)
甲烷与 定向转化制甲酸等物质的反应历程和能垒变化如图所示(部分自由基未画出)。有催化剂时,微粒吸附在催化剂表面进行反应。
(3)
利用甲酸钠脱除水体中的
定向转化制甲酸等物质的反应历程和能垒变化如图所示(部分自由基未画出)。有催化剂时,微粒吸附在催化剂表面进行反应。
(3)
利用甲酸钠脱除水体中的 , 反应的还原主产物是
, 反应的还原主产物是 , 存在中间产物
, 存在中间产物 和副产物
和副产物 , 其他可能的还原产物不考虑。水体中
, 其他可能的还原产物不考虑。水体中 初始浓度为
初始浓度为 , 测得过程中
, 测得过程中 和
和 (
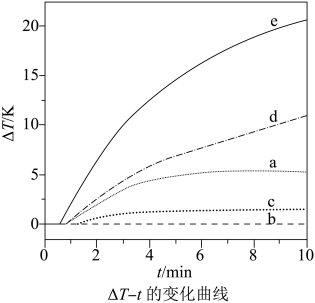
( 元素的含量)随时间变化如图所示。
元素的含量)随时间变化如图所示。 时
时 转化完全,检测不到
转化完全,检测不到 。
(4)
已知
。
(4)
已知 ,
,  。常温下,
。常温下, 的甲酸钠溶液中,
的甲酸钠溶液中, (填“>”“<”或“=”)
(填“>”“<”或“=”) , 溶液
, 溶液 (写出此空的计算过程)。
(写出此空的计算过程)。
已知:

①下列说法不正确的是。
A.甲烷定向制甲酸的反应是放热反应
B.该过程的决速步是甲烷产生自由基过程
C.从ⅰ→ⅱ的过程中,存在
D.微粒ⅱ和ⅲ是反应的中间体
②由生成
的过程中,
产生自由基的过程可表示为。

①中N原子的杂化方式是。
②从开始到转化完全时,反应速率为(保留3位有效数字,下同)
, 氮的脱除效率(
)可以达到。
【考点】
盖斯定律及其应用;
能力提升
真题演练