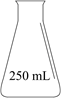
1.
洁厕灵主要成分为盐酸,能有效消除卫生间臭味并杀菌。某同学欲用市售盐酸配制230mL洁厕灵(盐酸浓度为1.2mol/L),可供选择的仪器如图所示。请回答下列问题:


(1)
如图所示的仪器中,配制上述溶液一定不需要的是(填序号),配制过程中还需要的玻璃仪器有。
(2)
应量取浓盐酸的体积为mL。
(3)
如果取5mL该浓盐酸加等质量的水稀释,那么稀释后的盐酸的质量分数18.25%(填“大于”“小于”或“等于”下同),稀释后盐酸的物质的量浓度原浓盐酸物质的量浓度的一半。
(4)
装置C标有以下5项中的(填序号,下同);装置A应为下图中的。
(5)
下列情况会配制溶液的物质的量浓度偏高的是(填序号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线。

A.量取盐酸时俯视刻度线
B.在烧杯中稀释盐酸后立即转移到容量瓶中
C.定容时,俯视刻度线
D.将洗涤量筒、烧杯、玻璃棒的洗涤液一并转移到容量瓶中
E.在稀释过程中有少量液体溅出烧杯外
【考点】
配制一定物质的量浓度的溶液;
能力提升
真题演练