1.
我国力争于2060年前实现碳中和。将 转化为甲醇是实现碳中和的重要手段,涉及的主要反应以及反应在不同温度下的化学平衡常数如表所示:
转化为甲醇是实现碳中和的重要手段,涉及的主要反应以及反应在不同温度下的化学平衡常数如表所示:
化学反应 | 平衡常数 | 温度 | |
500 | 800 | ||
① | 2.5 | 0.15 | |
② | |||
③ | 2.5 | 0.375 | |
回答下列问题:
(1)
基态 原子价层电子的轨道表示式为。
(2)
反应①的
原子价层电子的轨道表示式为。
(2)
反应①的 0(填“>”或“<”);表中
0(填“>”或“<”);表中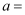 ;
(3)
反应③过程的能量变化如图所示(图中各物质均为气态),下列说法正确的是_______(填选项字母)。
;
(3)
反应③过程的能量变化如图所示(图中各物质均为气态),下列说法正确的是_______(填选项字母)。

 B.
反应达到平衡后,升温,再次平衡时
B.
反应达到平衡后,升温,再次平衡时 减小,
减小, 增大
C.
加入催化剂,主要降低反应
增大
C.
加入催化剂,主要降低反应 的活化能
D.
增大压强,反应
的活化能
D.
增大压强,反应 的
的 (正)减小,
(正)减小, (逆)增大
(4)
研究反应③的催化剂选择时,其他条件不变,仅改变催化剂的种类,对反应器出口产品进行成分分析,结果如图所示。在图示催化剂中,反应③应选择的最佳催化剂及选择理由是。
(5)
在不同压强下,按照
(逆)增大
(4)
研究反应③的催化剂选择时,其他条件不变,仅改变催化剂的种类,对反应器出口产品进行成分分析,结果如图所示。在图示催化剂中,反应③应选择的最佳催化剂及选择理由是。
(5)
在不同压强下,按照 投料,实验测定
投料,实验测定 的平衡转化率和
的平衡转化率和 的平衡产率随温度变化的关系如图甲、乙所示:
(6)
一定条件下(
的平衡产率随温度变化的关系如图甲、乙所示:
(6)
一定条件下( ,
,  ),向体积为
),向体积为 的恒容密闭容器中通入
的恒容密闭容器中通入 和
和 发生上述反应,测得
发生上述反应,测得 的平衡转化率和
的平衡转化率和 的平衡产率如(5)图甲、乙所示,反应③的平衡常数为(写出计算过程)。
的平衡产率如(5)图甲、乙所示,反应③的平衡常数为(写出计算过程)。



已知:的平衡转化率
,
的平衡产率
。
其中纵坐标表示的平衡转化率的是图(填“甲”或“乙”)。
【考点】
化学平衡常数;
能力提升
真题演练







