1.
某科学兴趣小组用实验室常用药品(或溶液)对“NaOH溶液与稀盐酸是否恰好完全反应”进行探究。
【实验探究】
(1)
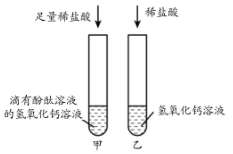
方案Ⅰ:某同学先向试管中加入约2mLNaOH溶液,再滴入几滴酚酞溶液,溶液变
(2)
方案Ⅱ:
【实验反思】
(3)
除以上方案外,下列哪些物质单独使用,也能证明“NaOH 溶液与稀盐酸是否恰好完全反应”____(填序号)。
A.
铜片
B.
pH试纸
C.
氧化铜
D.
紫色石蕊试液
红,然后慢慢滴入稀盐酸,边滴边振荡,直至溶液恰好变为无色。
① 实验结论。
② 从微观的角度分析,该反应的实质是。
实验步骤 | 实验现象 | 结论 |
取2mLNaOH溶液于试管中,滴入一定量的稀盐酸,振荡后加入镁条 | 若有气泡产生 | 稀盐酸过量 |
若没有明显现象 | NaOH溶液与稀盐酸恰好完全反应 |
另有同学提出方案Ⅱ不能证明NaOH溶液与稀盐酸恰好完全反应,其原因是
。
【考点】
酸与碱的反应及用途;
能力提升
真题演练