1.
氧化还原反应是一类重要的化学反应,广泛存在于生产、生活中。回答下列问题:
(1)
以乙烯 脱硫的方法治理燃煤尾气中的
脱硫的方法治理燃煤尾气中的 , 其机理如图所示。过程i、ii、iii中涉及氧化还原反应的是,图中涉及的物质属于非金属单质的是(填化学式)。
(2)
某工业废水含有大量对人体健康有危害的
, 其机理如图所示。过程i、ii、iii中涉及氧化还原反应的是,图中涉及的物质属于非金属单质的是(填化学式)。
(2)
某工业废水含有大量对人体健康有危害的 , 为了降低废水中
, 为了降低废水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 , 其化学方程式为
, 其化学方程式为 。
(3)
已知
。
(3)
已知 均有还原性,它们在酸性溶液中会发生如下反应:
均有还原性,它们在酸性溶液中会发生如下反应:

①中
的化合价为。
②上述反应中,被氧化的元素是(填元素符号),被氧化的元素(填“得到”或“失去”)电子;还原产物的化学式为。
③反应中每生成1个 , 转移个电子。
①
②
③
则的还原性由强到弱的顺序为(用“>”连接)。
【考点】
氧化性、还原性强弱的比较;
氧化还原反应方程式的配平;
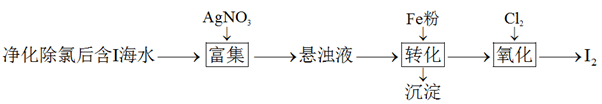
能力提升
真题演练