1.
某小组探究 被
被 氧化的产物,设计了以下实验,向等量的铜粉和
氧化的产物,设计了以下实验,向等量的铜粉和 的固体混合物中分别加入等体积不同浓度的
的固体混合物中分别加入等体积不同浓度的 溶液,实验现象如下:
溶液,实验现象如下:
编号 | 实验现象 | |
实验Ⅰ | 极少量 | |
实验Ⅱ |
|
已知:①易溶于
溶液,发生反应:
(红棕色);
和
氧化性几乎相同。
②铜元素被氧化可能存在的形式有(蓝色)、
(无色)、
(白色沉淀);
③(无色),易被空气氧化。
请回答:
(1)
初始阶段, 被氧化的反应速率:实验Ⅰ实验Ⅱ(填“>”“<”或“=”)。
(2)
继续探究实验Ⅱ中铜被碘氧化的产物,进行以下实验:
(3)
结合实验Ⅱ,推测实验Ⅰ中的白色沉淀可能是
被氧化的反应速率:实验Ⅰ实验Ⅱ(填“>”“<”或“=”)。
(2)
继续探究实验Ⅱ中铜被碘氧化的产物,进行以下实验:
(3)
结合实验Ⅱ,推测实验Ⅰ中的白色沉淀可能是 , 实验Ⅰ中铜被氧化的化学方程式是。取实验Ⅰ中洗涤后的白色沉淀,加入足量
, 实验Ⅰ中铜被氧化的化学方程式是。取实验Ⅰ中洗涤后的白色沉淀,加入足量 溶液并充分振荡,现象为。
(4)
上述实验结果表明,
溶液并充分振荡,现象为。
(4)
上述实验结果表明, 仅将
仅将 氧化为
氧化为 价。在隔绝空气的条件下进行电化学实验,证实了
价。在隔绝空气的条件下进行电化学实验,证实了 能将
能将 氧化为
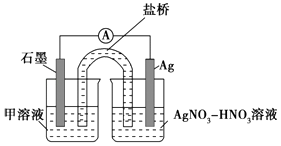
氧化为 。装置如图所示,物质a是;溶液b是;电势:a电极石墨电极(填“<”,“=”或“>”)。
。装置如图所示,物质a是;溶液b是;电势:a电极石墨电极(填“<”,“=”或“>”)。

①步骤一实验中使用的玻璃仪器主要有。加入萃取分液的目的是。
②用离子方程式表示步骤二中发生的反应。

【考点】
性质实验方案的设计;
原电池工作原理及应用;
能力提升
真题演练