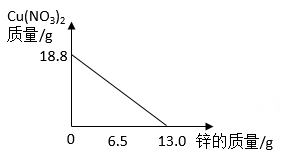
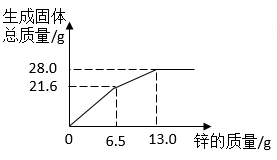
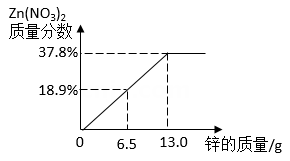
1.
小明在老师的指导下测一瓶稀盐酸的溶质质量分数,具体步骤如下:
步骤一:配制溶质质量分数为的氢氧化钠溶液。
步骤二:向克待测稀盐酸中逐滴滴入上述氢氧化钠溶液,并使用
计记录溶液的
变化情况,绘制图像如下图。

氢氧化钠溶液/质量/克
(1)在步骤一中需要用到的玻璃仪器有___________(写出两种)。
(2)已知发生反应的化学方程式为: , 请结合上图,计算该稀盐酸的溶质质量分数。(结果精确到
)
(3)在往稀盐酸中逐渐滴入氢氧化钠溶液的过程中,当溶液的达到
时,溶液中的溶质有___________。(用化学式表示)
【考点】
根据化学反应方程式的计算;
能力提升
变式训练
拓展培优
真题演练