1.
苯硫酚(C6H5SH,也写作PhSH)是一种用途广泛的有机合成中间体。工业上用常用氯苯(C6H5Cl)和硫化氢(H2S)为主要原料制备苯硫酚,但会有副产物苯(C6H6 , 也写作PhH)生成。
I:C6H5Cl(g)+H2S(g)→C6H5SH(g)+HCl(g) ΔH1=-16.8 kJ·mol-1
II:C6H5Cl(g)+H2S(g)→C6H6(g)+ HCl(g)+1/8S8(g) ΔH2
反应II的焓变不易测量,现查表得如下数据:
III: C6H5SH(g)→C6H6(g)+1/8 S8(g) ΔH3=-29.0 kJ·mol-1
现将一定量的氯苯和硫化氢置于一固定容积的容器中模拟工业生产过程,在不同温度下均反应20min测定生成物的浓度,得到图二。

(1)
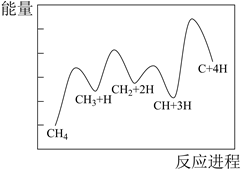
反应 I、II的能量变化如图一所示,则在相同条件下反应速率v(I)v(II)(填写“>”,“<”,“=”)。
(2)
图二可知,790K时所测生成物苯硫酚浓度减小,可能的原因为。(任写一种)
(3)
590K时,2mol氯苯和5mol硫化氢混合气体在V L的固定容积中进行反应I和II,达到平衡时,测得容器中苯硫酚的物质的量为1mol,苯的物质的量为0.5mol,则该温度下反应I的平衡常数为。(结果保留两位小数)
【考点】
活化能及其对化学反应速率的影响;
化学平衡常数;
能力提升
真题演练