1.
乙烷是一种重要的化工原料,可用作制冷剂、燃料、制备乙烯的原料。回答下列问题:
已知:①
②
③
(1)
乙烷催化氧化裂解法是一种新型的制备乙烯的方法,则

 。
(2)
1000℃时,在某刚性密闭容器内充入一定量的
。
(2)
1000℃时,在某刚性密闭容器内充入一定量的 , 只发生反应①,若平衡时容器中总压为pPa,乙烷的转化率为
, 只发生反应①,若平衡时容器中总压为pPa,乙烷的转化率为 , 则该反应的平衡常数
, 则该反应的平衡常数 Pa(用含p、
Pa(用含p、 的代数式表示,
的代数式表示, 为用分压表示的平衡常数)。达到平衡后,欲同时增大反应速率和乙烷的转化率,可采取的措施有(填选项字母)。
(3)
乙烷的氧化裂解反应产物中除了
为用分压表示的平衡常数)。达到平衡后,欲同时增大反应速率和乙烷的转化率,可采取的措施有(填选项字母)。
(3)
乙烷的氧化裂解反应产物中除了 外,还存在
外,还存在 、CO、C等副产物。图甲为温度对乙烷氧化裂解反应性能的影响,图乙为
、CO、C等副产物。图甲为温度对乙烷氧化裂解反应性能的影响,图乙为 的值对乙烷氧化裂解反应性能的影响。
的值对乙烷氧化裂解反应性能的影响。 较低时,生成乙烯的选择性较低的原因可能是氧气过量,乙烷发生深度氧化而导致乙烯的选择性降低
D.
反应的最佳温度为700℃左右
(4)
最新研究发现在乙烷的氧化裂解反应体系中充入一定量
较低时,生成乙烯的选择性较低的原因可能是氧气过量,乙烷发生深度氧化而导致乙烯的选择性降低
D.
反应的最佳温度为700℃左右
(4)
最新研究发现在乙烷的氧化裂解反应体系中充入一定量 能更好的提高乙烷的转化率和乙烯的收率,请结合方程式说明原因。
(5)
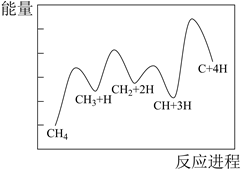
科技工作者结合实验与计算机模拟结果,研究了乙烷在催化剂表面脱氢制乙烯的反应,其部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS表示过渡态)。此部分历程中决速步骤的反应方程式为。
能更好的提高乙烷的转化率和乙烯的收率,请结合方程式说明原因。
(5)
科技工作者结合实验与计算机模拟结果,研究了乙烷在催化剂表面脱氢制乙烯的反应,其部分历程如下图所示(吸附在催化剂表面的物种用*标注,TS表示过渡态)。此部分历程中决速步骤的反应方程式为。
A.升高温度 B.通入惰性气体 C.增加乙烷浓度 D.加入催化剂

[乙烯选择性;乙烯收率=乙烷转化率×乙烯选择性]
下列说法正确的是___________。
A. 有利于提高乙烷平衡转化率的条件是高温低压 B. 乙烷的转化率随温度的升高而增大的原因是此时反应未达平衡,升高温度,反应速率加快,反应物的转化率增大 C.
【考点】
活化能及其对化学反应速率的影响;
化学平衡常数;
能力提升
真题演练