铜及其化合物在生产、生活中都有广泛的应用。
I.铜的性质及其应用
圆明园十二生肖兽首中的兔首为青铜器(铜、锡合金),兔首表面呈有绿色斑点,这是因为铜器长期暴露在空气中生了铜绿(主要成分为碱式碳酸铜,化学式为Cu2(OH)2CO3)。
探究铜生锈的条件。
①依据铜绿组成和查阅资料判断,铜绿可能是铜与氧气及共同作用而形成的。
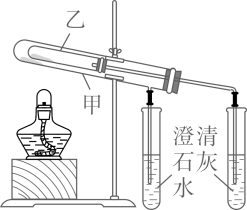
②借鉴课本“铁钉锈蚀条件的探究”实验,小泽设计了“铜片锈蚀条件的探究”实验,实验如图所示(所用铜片洁净、光亮);实验较长时间后,发现试管中铜片最先生锈(填试管字母编号)。

③小俊认为小泽设计的实验还不够完善,要得出正确的结论,还要补充一个实验。你认为小俊要补充的一个实验是。
④小泮发现从不同地点收集到的两个铜器(一个材质是纯铜,一个材质是青铜)中,纯铜器的铜绿比青铜器的少,他据此分析认为青铜比纯铜易锈蚀。小泮的分析是(填“全面”或“不全面”)。
Ⅱ.铜的制备研究
黄铜矿(主要成分是CuFeS2)是重要的含铜矿物,常用于冶炼金属铜。

写出黄铜矿在潮湿的空气中发生反应的化学方程式:。


细菌冶铜时,当黄铜矿中伴有黄铁矿可明显提高Cu2+的浸出速率,其原理如右图所示:
①冶炼过程中,FeS2周边溶液的pH(填“增大”、“减小”或“不变”)。
②火法炼铜时,由CuS2制得铜的原理是 。
两种炼铜方案中,“细菌冶铜”相比“火法炼铜”的优点是(答一点即可)。
III.铜的化合物的制备研究

已知:“酸浸”时X是稀硫酸和稀硝酸的混合酸,发生的反应为 。
①“结晶”时的操作为、冷却结晶。
②实验室可采用沉淀法测定所得胆矾晶体中CuSO4·5H2O的含量,经加水充分溶解,加入足量BaCl2溶液,过滤、洗涤、干燥、称量,最后得到沉淀23.3g。在过滤前,需要检验是否沉淀完全,检验方法是:静置后,向上层清液中,该实验流程获得胆矾的产率为。(写出计算过程)